
期刊:Journal of Translational Medicine
影响因子:6.1
伯豪技术服务产品:单细胞转录组测序
导语
尽管安罗替尼联合PD-1阻断疗法为晚期非小细胞肺癌(NSCLC)带来希望,但部分患者仍面临耐药难题。最新研究通过单细胞测序分析4.7万个肿瘤微环境细胞,发现响应患者(MPR)呈现T细胞功能恢复及B细胞- T细胞协同激活,而耐药患者(Non-MPR)中肿瘤相关巨噬细胞通过VEGF-ZEB1-FLT1轴介导内皮细胞耐药,关键酶PLA2G4A更驱动Treg浸润形成免疫抑制!该研究为逆转耐药提供了精准靶点。
科学问题
1.耐药机制:尽管联合疗法在临床试验中显示生存获益,但部分患者仍无响应,其分子和细胞层面的机制尚不明确。
2.肿瘤微环境(TME)动态变化:抗血管生成药物与免疫治疗的协同作用如何通过重塑TME(如免疫细胞、内皮细胞、成纤维细胞的互作)影响疗效。
3.VEGF信号通路的作用:VEGF信号如何介导治疗响应或耐药,尤其是与免疫抑制表型(如Treg细胞浸润)的关联。
实验材料:6例晚期NSCLC患者(接受新辅助安罗替尼联合PD-1阻断治疗后手术切除的肿瘤组织),分为:MPR组(主要病理缓解,3例)、Non-MPR组(非主要病理缓解,3例)
3例治疗前(TN)患者的活检样本(从基因组序列存档数据库下载,编号HRA001033)
主要技术
单细胞转录组测序
(技术服务由伯豪生物提供)
研究结果
1. 非小细胞肺癌新辅助治疗样本的单细胞RNA测序分析
本研究收集了6例接受新辅助联合治疗后手术切除的晚期NSCLC患者的肿瘤样本,通过病理评估分为:MPR组(主要病理缓解,n=3)、Non-MPR组(非主要病理缓解,n=3),另下载3例初治(TN)患者的活检样本scRNA-seq数据作为对照。经质控和去重后,最终对47,294个细胞的转录组数据进行分析(图1A)。对所有 9 个病例中的所有细胞进行无监督聚类分析,识别出 23 个簇,根据标记基因的表达,注释为上皮细胞、内皮细胞、成纤维细胞、T 细胞、B 细胞、平滑肌细胞和髓系细胞(图 1 B, C)。
为探究治疗对肿瘤微环境的重塑作用,作者统计了患者各类细胞比例(图1D)。在有限病例中发现:Non-MPR患者治疗后T细胞比例下降而髓系细胞增加(图1E)。进一步分析NSCLC中细胞间相互作用,发现上皮细胞通过VEGF信号与内皮细胞互作(图1F),而髓系细胞与成纤维细胞、内皮细胞及上皮细胞存在强相互作用(图1G)。
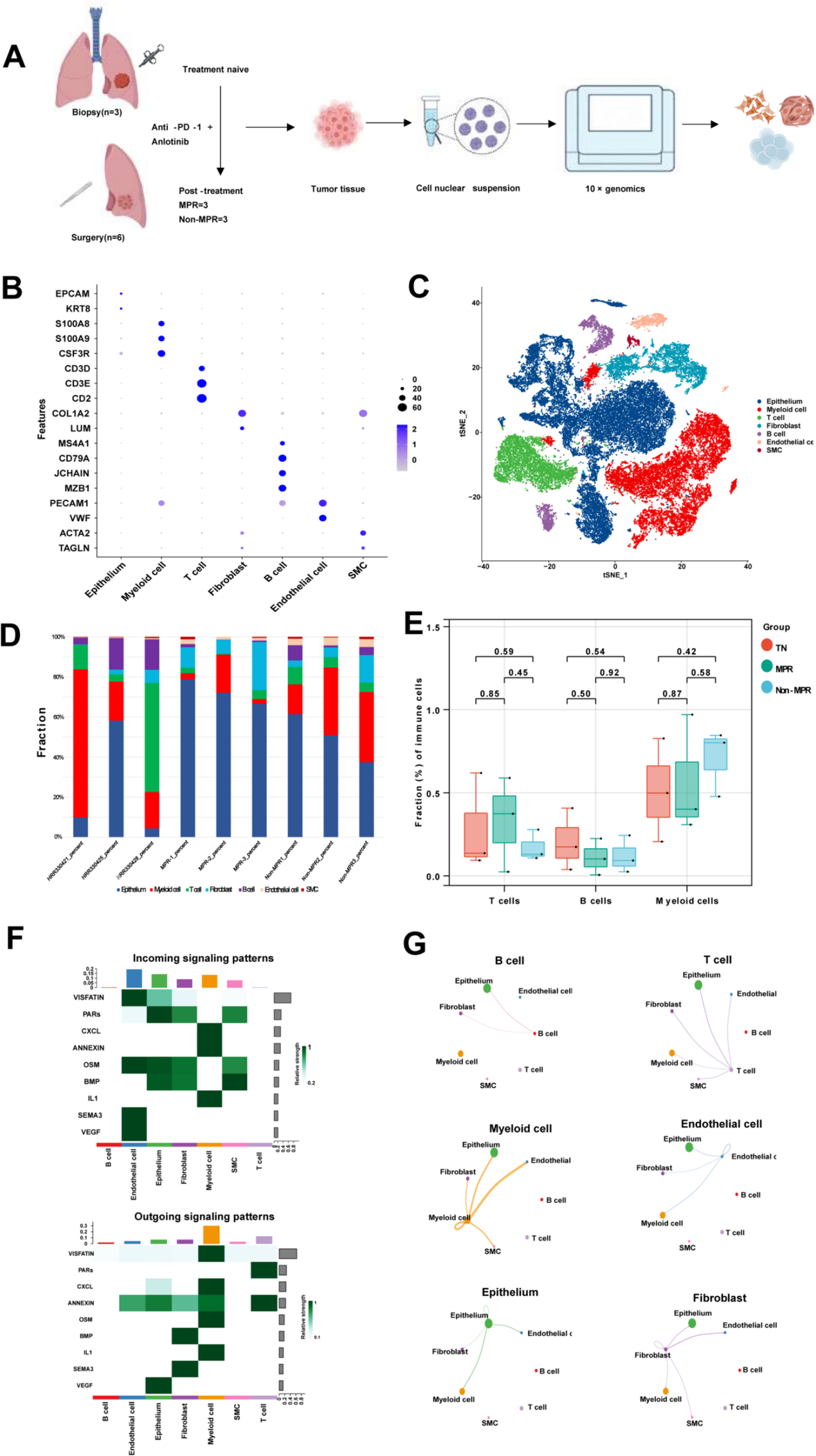
图1 非小细胞肺癌新辅助治疗样本的单细胞RNA测序分析
2.T细胞向调节性T细胞(Tregs)的转化提示病理反应不佳
作者重新聚类了 T/NK 细胞,并识别出 7 个簇(图 2 A, B)。这些簇包括 1 种 T 细胞亚型、1 种 NK 细胞亚型(NK_KLRD1)、1 种 CD8 + T 细胞亚型(CD8_GZMK)、3 种 CD4 + T 细胞亚型(CD4_CCR7、CD4_CD40LG 和 CD4_CD28)以及 1 种 Treg 细胞亚型(Treg_CTLA4)。通过细胞亚群比例比较发现,CD4+ T细胞数量显著多于CD8+ T细胞。与初治组(TN)和Non-MPR组相比,MPR组患者中高表达IL2RA和TIGIT的Treg_CTLA4细胞减少,而CD4_CCR7细胞增加(图2C)。进一步鉴定出7个基因(AG3、TIGIT、PCCD1、HAVCR2、CTLA4、LAYN和ENTPD1)构成T细胞耗竭特征标记。治疗后,CD4_CCR7细胞的耗竭特征显著降低(尤其在MPR组)(图2D),且MPR组的Treg细胞耗竭特征也低于Non-MPR组(图2D)。代谢特征分析显示,Treg_CTLA4细胞呈现活跃的丙酮酸代谢,而CD4_CCR7和CD4_CD40LG细胞则以氧化磷酸化为主(图2E)。多色免疫荧光(mIHC)结果一致表明,Non-MPR组的CTLA4+FoxP3+CD4+ T细胞数量明显多于MPR组(图2F),证实治疗后MPR患者的Treg细胞比例下降。
同时,T_THEMIS细胞在接受联合治疗后增加(图2C)。THEMIS是一种参与T细胞激活调控的经典调节蛋白,是T细胞阳性选择过程中的关键因素。与其它细胞簇相比,作者观察到 T_THEMIS 细胞在氨基酸代谢方面更为活跃,例如“氨基酸-tRNA 生物合成”通路和“缬氨酸、亮氨酸和异亮氨酸降解”通路(图2E)。因此,作者进行了轨迹分析,以探索T_THEMIS细胞在肿瘤组织中的转变(图2G)。从起源(T_THEMIS)到初始T细胞(CD4_CCR7)和活化的调节性T细胞(Treg_CTLA4)存在两条转变路径。分析显示,T_THEMIS细胞的分化对于Treg细胞的扩增至关重要。作者发现T_THEMIS细胞在伪时间中的分布可以分为两个状态。在初级状态,T_THEMIS细胞高表达DLG2,而在活化状态下,MHC-II基因(HLA-A和HLA-C)的表达上调。CellPhoneDB分析揭示了整合素介导癌细胞与T_THEMIS细胞之间的通讯(图2H)。治疗后微环境中T_THEMIS细胞转变的机制需要进一步探索。
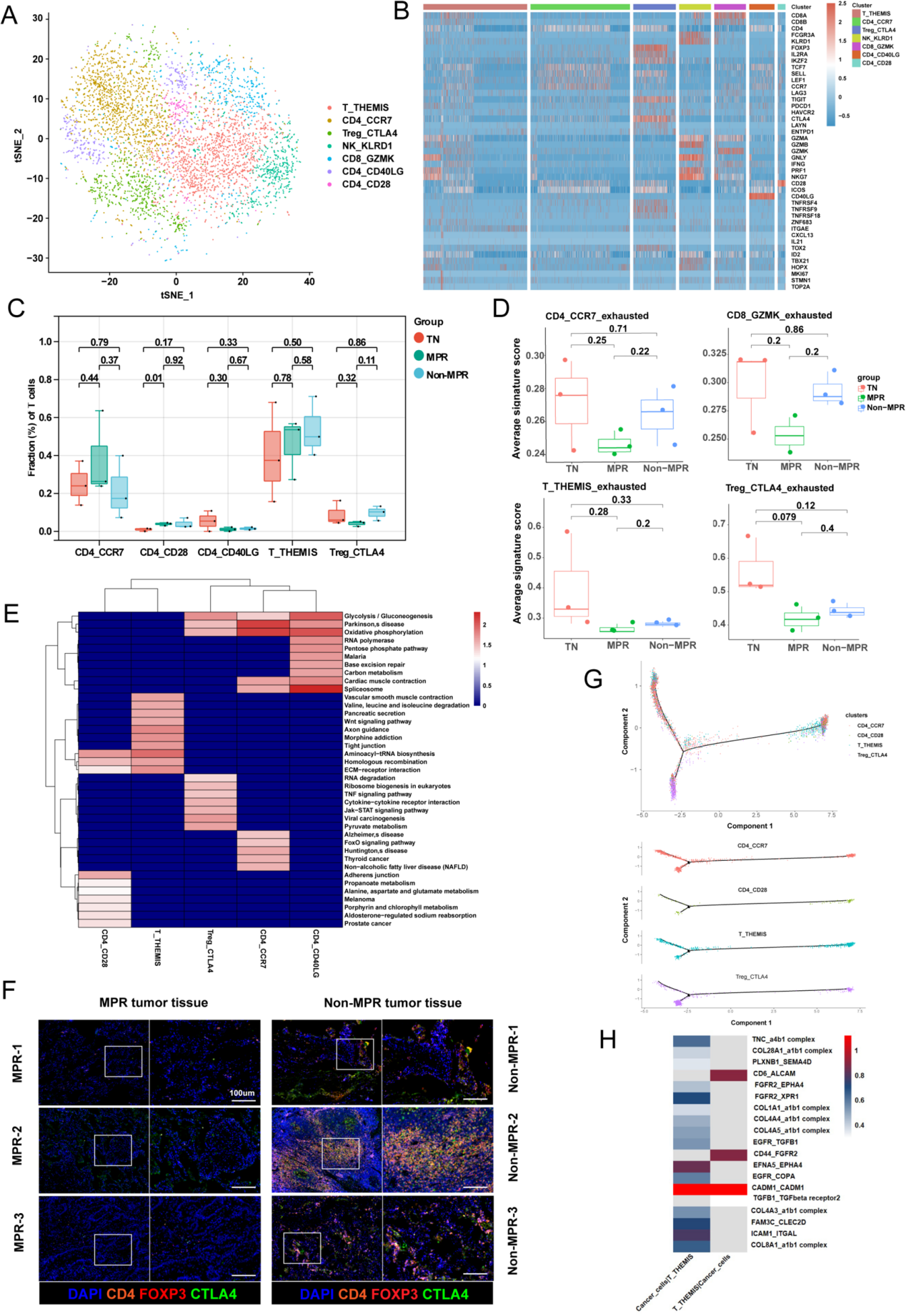
图2 T细胞向调节性T细胞(Tregs)的转化提示病理反应不佳
3.PAX5⁺记忆B细胞与CD4⁺T细胞之间的正反馈增强了抗肿瘤免疫反应
作者重新对B细胞进行了聚类,将其分为4个簇(图3A),包括3种浆细胞B细胞亚型(B1_PIM2、B2_JCHAIN和B3_IGHG3)和1种记忆B细胞亚型(B4_PAX5)。随后,作者比较了各亚型的比例,发现治疗后浆细胞B细胞的比例下降,而B4_PAX5记忆B细胞的比例增加,尤其是在主要病理缓解(MPR)患者中(图3B)。B4_PAX5细胞高表达免疫球蛋白受体(FCRL1)和B细胞功能调节因子(BANK1)。作者发现B4_PAX5细胞富集于“FcγR介导的吞噬作用”通路、“IgA产生”通路和“B细胞受体信号传导”通路(图3C)。
此外,mIHC 显示 CD20 + 细胞在 MPR 患者中比非 MPR 患者更浸润(图 3 D)。作者研究了 B4_PAX5 细胞是否可以作为预后的预测指标。在 KMplot 中,作者输入 PAX5、FCRL1 和 BANK1 进行多基因生存分析,发现较低的 B4_PAX5 特征与不良预后相关(图 3 E)。这些结果表明 B4_PAX5 细胞的特征可以作为 NSCLC 的预后预测指标。
作者进行了CellPhoneDB分析,以研究T细胞与B4_PAX5细胞之间相互作用的途径,结果表明B4_PAX5细胞可以通过以下方式与T细胞相互作用:CCL4-CNR2和IFNG-IFNR(图3F)。这些数据表明,在免疫微环境中,B4_PAX5细胞受到来自CD4_CD40LG细胞的CD40LG和来自CD4_CD28细胞的CD28的驱动,而T细胞则通过来自B4_PAX5细胞的FAM3C被激活,从而增强抗肿瘤免疫反应。
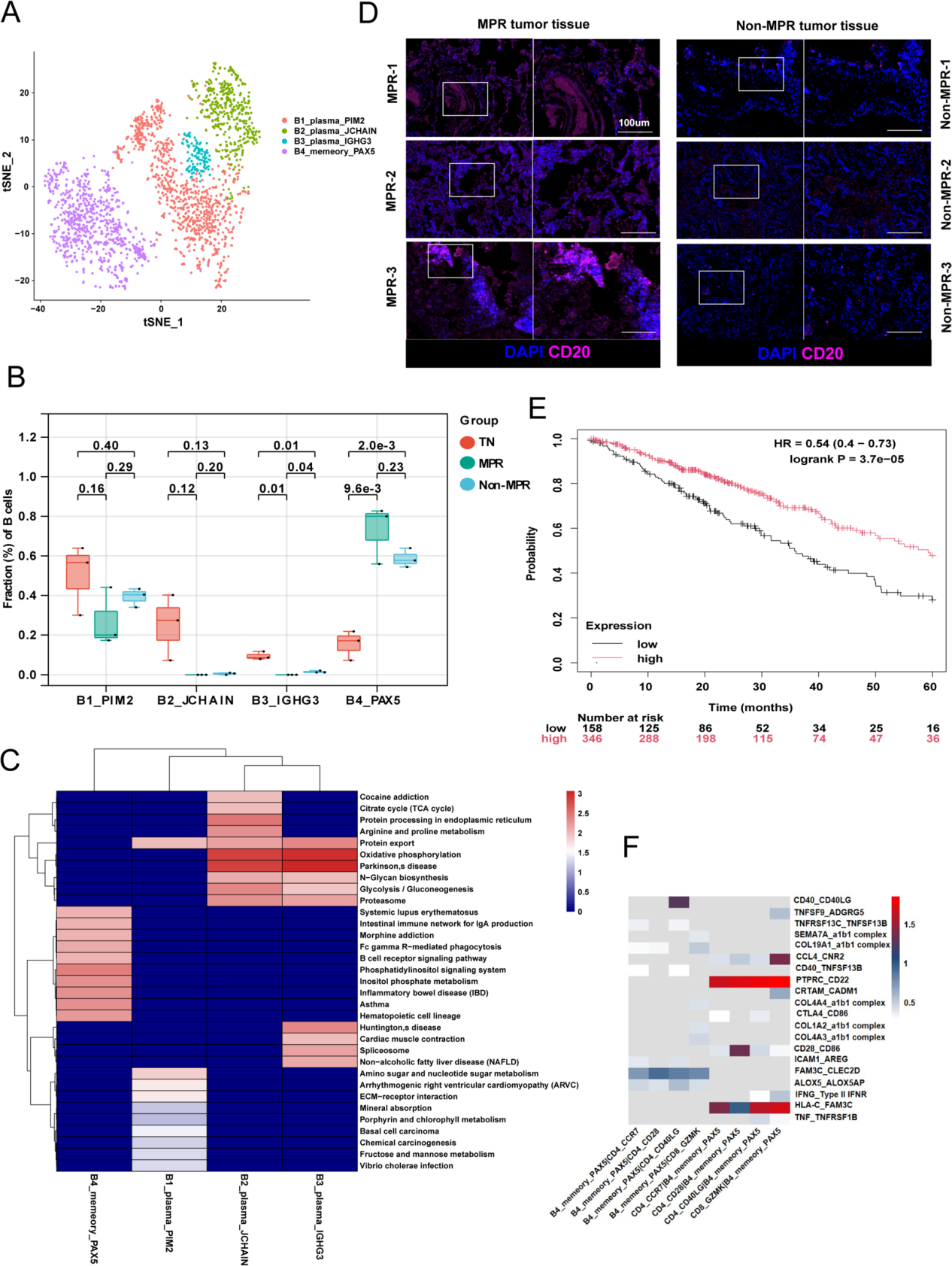
图3 PAX5⁺记忆B细胞与CD4⁺T细胞之间的正反馈增强了抗肿瘤免疫反应
4.肿瘤相关巨噬细胞通过作为细胞通讯枢纽削弱治疗效率
髓系细胞组分可划分为7个亚群,包括2个中性粒细胞亚群、2个巨噬细胞亚群、1个单核细胞亚群、1个树突状细胞亚群及1个肥大细胞亚群(图4A)。其中Mac1_PPARG细胞高表达M2型标志物(MRC1)及经典肺泡巨噬细胞标志物(FABP4和MARCO);而Mac2_CD163L1细胞则高表达HS3ST2与LGMN,并呈现更强的免疫抑制特征(C1QA、C1QB及APOE;图4B、C)。值得注意的是,治疗后Mac1_PPARG与Mac2_CD163L1巨噬细胞均有所增加,且Mac2_CD163L1巨噬细胞在非病理完全缓解(Non-MPR)患者中增幅尤为显著(图4D)。进一步通过多重免疫组化(mIHC)证实,CD68+细胞在Non-MPR患者中的浸润程度高于MPR患者(图4E)。
中性粒细胞可划分为2个亚群:1个成熟亚群(CXCR2高表达CXCR4低表达,标记为Neu1_KCNJ15)和1个衰老亚群(CXCR2低表达CXCR4高表达,标记为Neu2_CXCL10;图4A、B)。其中,成熟亚群Neu1_KCNJ15高表达颗粒蛋白标志物(S100A8和S100A9)及中性粒细胞胞外诱捕网(NETs)标志物(LCP1),这些分子释放后在炎症通路中起关键作用;而衰老亚群Neu2_CXCL10则过表达多种因子(包括CXCL9、CXCL10和VEGFA)。治疗后,成熟Neu1_KCNJ15中性粒细胞数量显著减少(图4D)。
单核细胞亚群Mon_VCAN高表达单核细胞标志物(FCN1和VCAN)及更高水平的MHC-II分子(HLA-DRA、HLA-DPA1和CD74),提示其成熟状态;此外,该亚群还高表达TGFB1,呈现免疫抑制表型(图4B)。
此外,基于壳层图谱(shell map),作者对Mac2_CD163L1巨噬细胞与其他细胞间的互作进行分析,以探究治疗对巨噬细胞的重塑作用(图1G)。研究发现,Mac2_CD163L1巨噬细胞分泌的CXCL8、CCL3和IL18,分别通过CXCR1、CCR3和IL18R受体与中性粒细胞发生相互作用。同时,该巨噬细胞亚群可能通过分泌SPP1和CXCL2抑制T_THEMIS细胞及肿瘤细胞,并通过整合素(integrins)与成纤维细胞进行通讯(图4F)。这些结果表明,Mac2_CD163L1巨噬细胞不仅抑制T_THEMIS细胞和中性粒细胞的功能,还与癌症相关成纤维细胞存在密切关联。
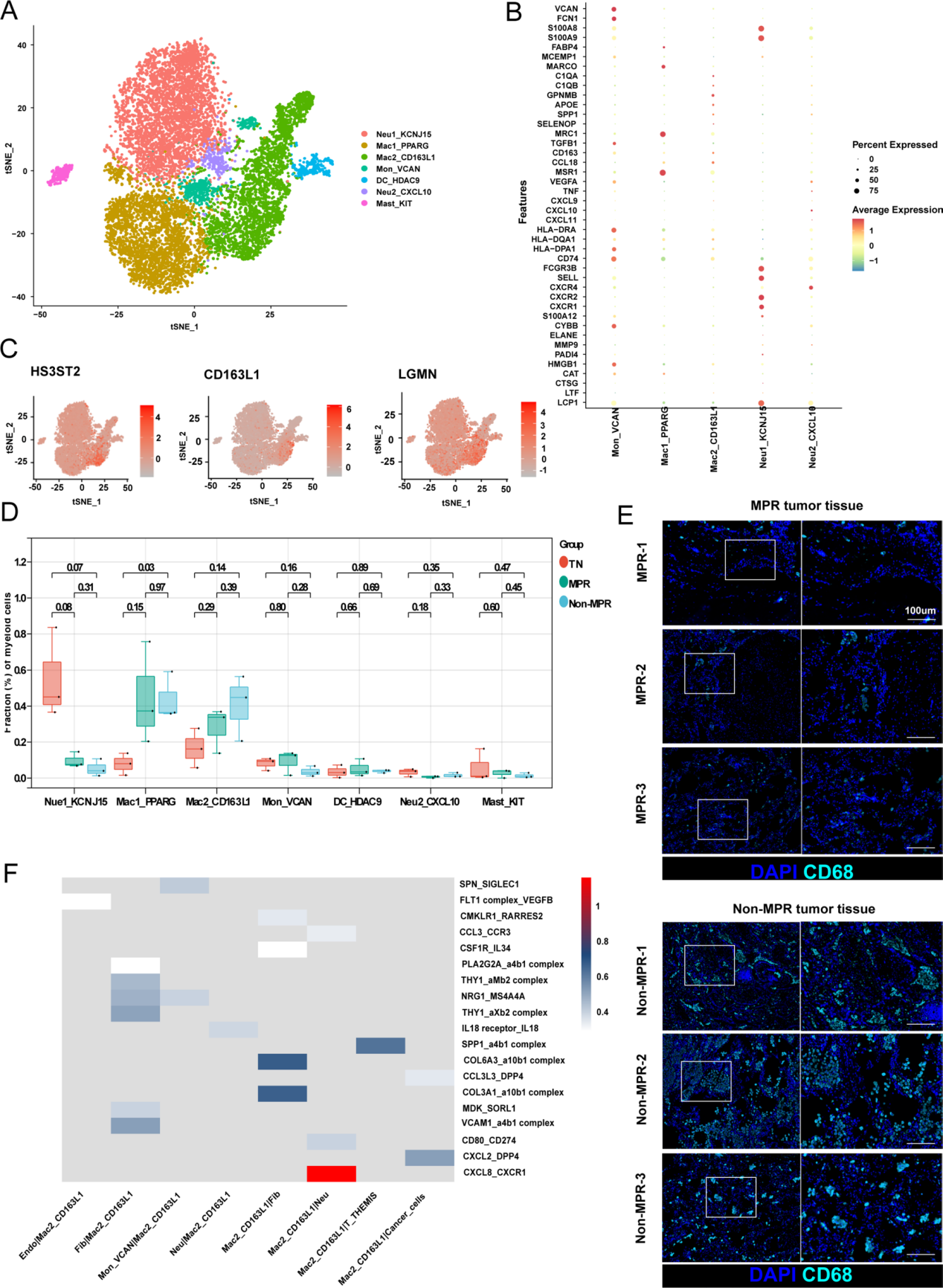
图4:肿瘤相关巨噬细胞通过作为细胞通讯枢纽削弱治疗效率
5. 内皮细胞可能通过ZEB1调控FLT1以响应安罗替尼治疗
间质成分可划分为8个亚群,包括2个内皮细胞亚群、5个成纤维细胞亚群和1个平滑肌细胞亚群(图5A)。作为安罗替尼的重要作用靶点,作者通过比较内皮细胞亚群比例来探究联合治疗对内皮细胞的重塑效应。
Endo1_FLT1细胞为血液内皮细胞,高表达FLT1(VEGFR)、EGFL7和PECAM1,且在非病理完全缓解(Non-MPR)患者中富集(图5B、C)。与此同时,Endo2_CD36内皮细胞总占比仅约5%,显著低于VEGFR阳性(Endo1_FLT1)细胞。这些结果表明,Non-MPR患者内皮细胞中VEGFR的表达与安罗替尼耐药性密切相关。
GSVA分析显示,病理完全缓解(MPR)患者的内皮细胞中氨基酸代谢通路显著富集,而非病理完全缓解(Non-MPR)患者的内皮细胞则呈现原发性免疫缺陷特征(图5D)。由于内皮细胞是外周免疫细胞与肿瘤细胞间的主要界面,负责传递免疫信号并呈递抗原表位,这一结果表明,Non-MPR患者的内皮细胞可能通过下调抗原呈递能力和免疫细胞归巢活性,促进肿瘤免疫逃逸表型,而联合治疗的疗效可能依赖于内皮细胞的正常化。
进一步利用SCENIC分析MPR与Non-MPR内皮细胞的差异转录因子及其靶基因(图5E),发现ZEB1在Non-MPR内皮细胞中高表达(图5F)。ZEB1不仅与免疫微环境中抑制性免疫细胞的增加相关,其结合位点还存在于VEGFR调控基因中,提示ZEB1可能通过调控VEGFR增强内皮细胞的免疫抑制表型。此外,研究发现内皮细胞可被成纤维细胞和Mac2_CD163L1巨噬细胞分泌的VEGF激活(图4F、5G),表明微环境中存在免疫抑制性细胞通讯反馈环路。在共培养体系中验证发现,安罗替尼可上调巨噬细胞的VEGFB(而非VEGFA)表达,并促进内皮细胞中VEGFR(FLT1)和ZEB1的表达。
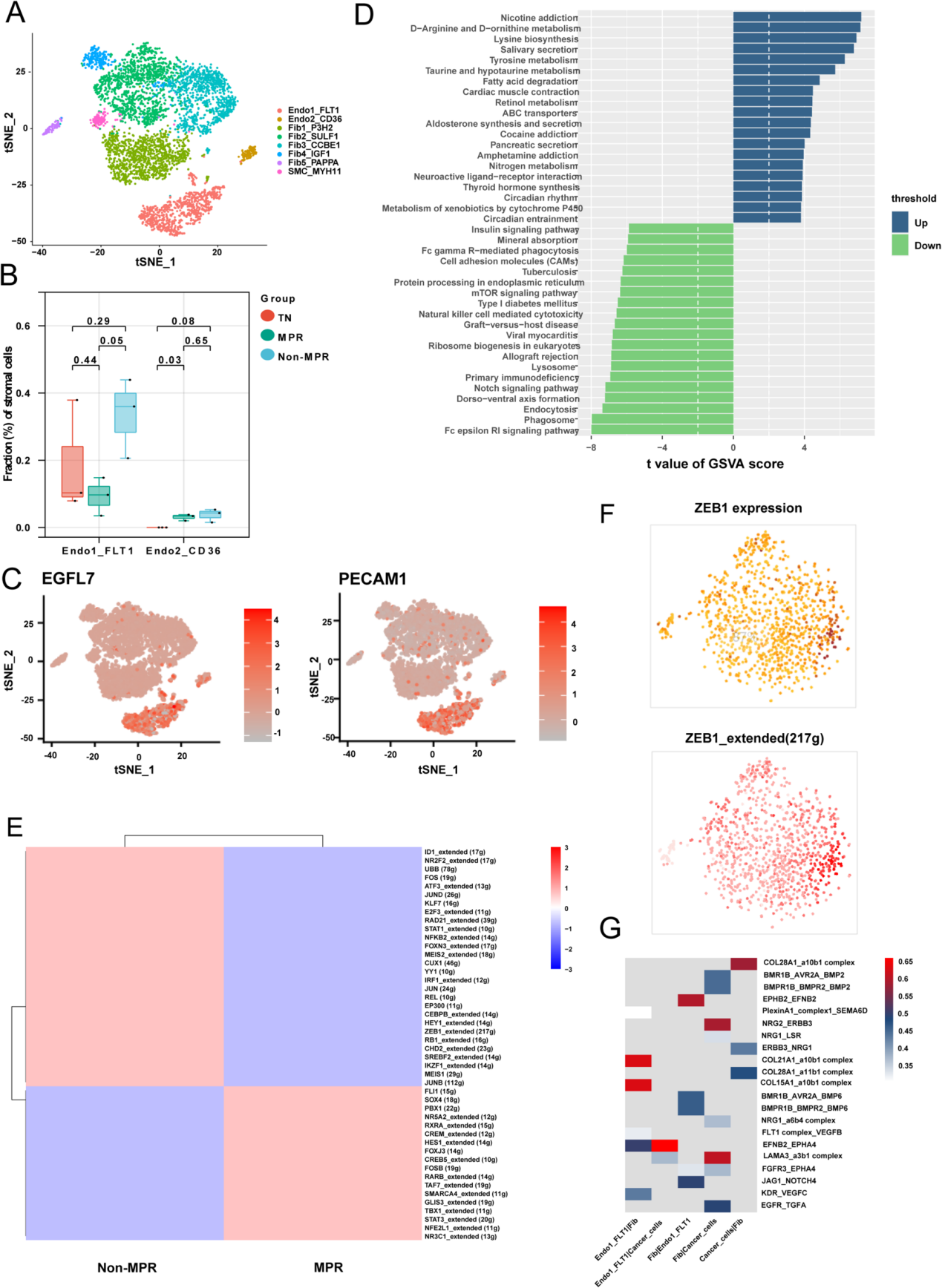
图5 内皮细胞可能通过ZEB1调控FLT1对安罗替尼的治疗响应
6. cPLA2促进调节性T细胞(Tregs)浸润并诱导耐药性
作者采用InferCNV分析从7个上皮细胞亚群中区分恶性与正常细胞(图6A)。除部分E1_ABCA3和E3_TP63细胞外,聚类分析显示E4_ACSL4与E5_BCAT1亚群被判定为癌细胞。治疗后,Non-MPR(非病理完全缓解)患者中E4_ACSL4和E5_BCAT1细胞比例显著增加。
通过富集分析,作者发现与非肿瘤组织(TN)和病理完全缓解(MPR)患者相比,非病理完全缓解(Non-MPR)患者中VEGF信号通路相关酶(PLA2G4A、PLA2G12A和PTK2)表达显著升高(图6B,C)。作者推测,肿瘤细胞可能通过上调PLA2G4A(cPLA2)来应对安罗替尼治疗对VEGF通路的抑制作用。
在共培养体系中验证VEGF信号分子表达变化时发现,与巨噬细胞共培养后,肿瘤细胞中PTK2、PLA2G4A和PLA2G12A表达上调,且安罗替尼处理增强了这一效应。PLA2家族酶能催化膜磷脂水解释放花生四烯酸,后者可进一步代谢为类二十烷酸物质,参与调控炎症反应和巨噬细胞极化。
进一步分析cPLA2在免疫微环境中的作用发现,cPLA2表达与FoxP3呈正相关,与CD4呈负相关(图6D,E)。此外,TCGA数据显示cPLA2高表达与不良预后相关,作者的NSCLC队列研究也证实PLA2G4A是一个独立预后因素(图6F,G)。这些结果表明,以PLA2G4A为代表的PLA2可能通过促进调节性T细胞(Tregs)浸润参与免疫抑制,作者推测花生四烯酸代谢产物可能通过肿瘤相关巨噬细胞(TAMs)的SPP1信号通路,促进T_THEMIS细胞向Tregs转化(图4F)。
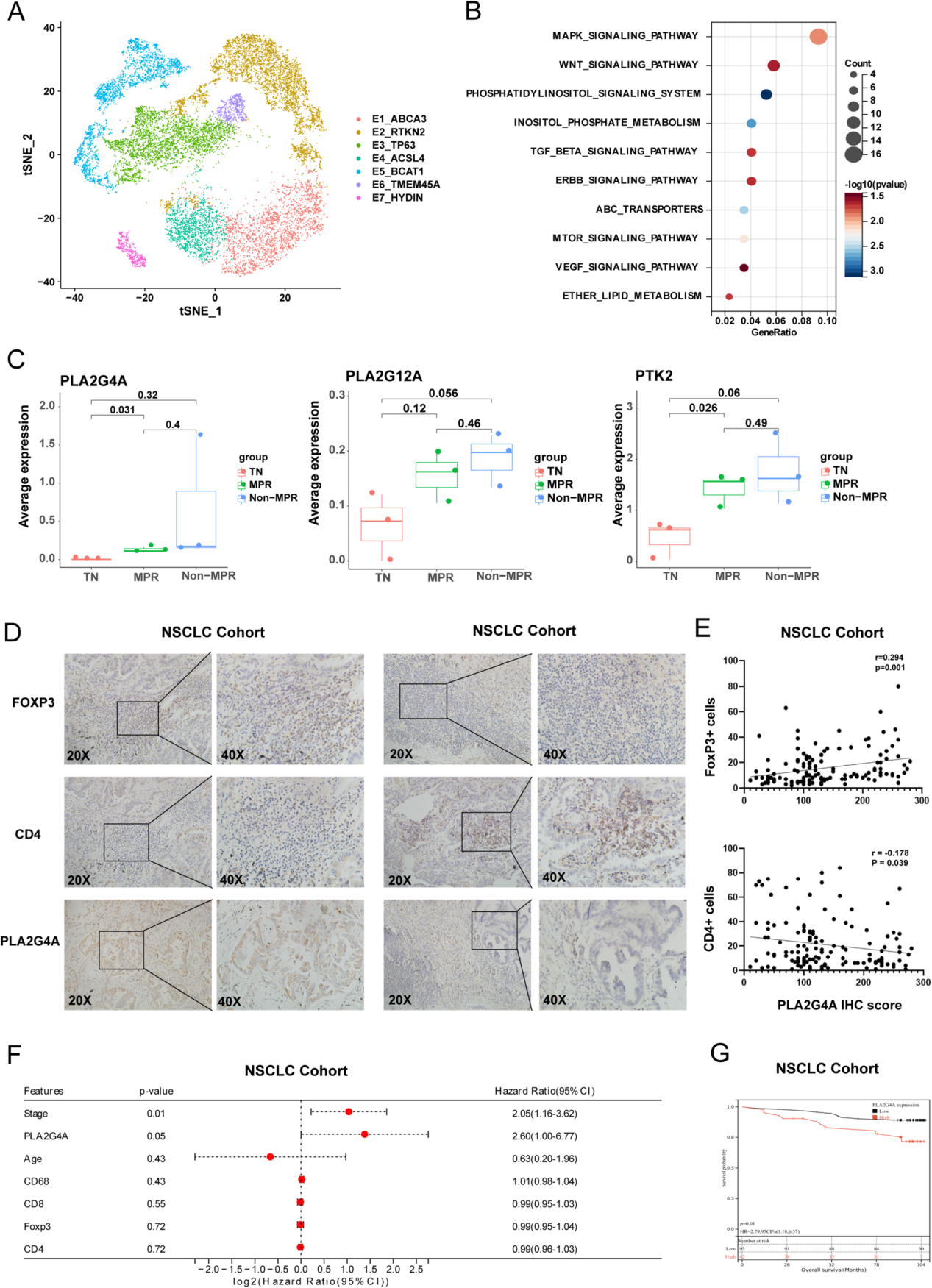
图6 cPLA2促进调节性T细胞(Tregs)浸润并诱导耐药性
研究结论
在这项研究中,作者构建了接受新辅助安罗替尼联合 PD-1 阻断治疗的非小细胞肺癌患者的单细胞转录组图谱,揭示了肿瘤免疫微环境中的细胞群体异质性和治疗失败的可能潜在机制。作者发现,VEGF 信号通路依赖的血管内皮细胞和上皮细胞的动态变化对非小细胞肺癌患者安罗替尼耐药性和免疫抑制表型的形成具有深远影响。
参考文献:
Huang Z, Li L, Zhao X, Jin H, Shen M, Li B, Zeng Y, Zhang Q, Wang Q, Wang M, Yang L. scRNA-seq reveals that VEGF signaling mediates the response to neoadjuvant anlotinib combined with PD-1 blockade therapy in non-small cell lung cancer. J Transl Med. 2025 Apr 25;23(1):478. doi: 10.1186/s12967-025-06485-4. PMID: 40281576; PMCID: PMC12032801.
